抑郁症是一种严重危害人类健康的精神疾病。临床上偶然发现亚麻醉剂量的氯胺酮具有快速且长效的抗抑郁作用[1, 2]。而氯胺酮抗抑郁作用的发现给抑郁症的治疗领域带来了革命性的发展。因此神经科学家们针对氯胺酮的抗抑郁机制展开了广泛的研究,但截至目前为止,关于氯胺酮抗抑郁的神经机制,以及其作用的靶点分子和靶点脑区仍未有一个明确的定论。
2024年8月9日,浙江大学基础交叉研究院筹备建设研究领域“新医科”交叉研究领域领军科学家胡海岚教授团队在《Science》杂志上发表题为“Brain region–specific action of ketamine as a rapid antidepressant”的研究论文,在“新医科”前沿科学研究方面取得新突破,基础交叉研究院为通讯作者单位之一。本文回答了外侧缰核为什么成为了氯胺酮作用首先靶向的脑区,揭示了该脑区特异性作用的神经基础,并描述了从外侧缰核到海马脑区之间上下游信号通路的联系。这一研究成果进一步丰富了团队提出的以外侧缰核NMDA受体为核心的氯胺酮抗抑郁作用脑机制理论体系,为研究氯胺酮的抗抑郁神经机制提供了全新的视角,为临床上氯胺酮的用药策略以及新型药物的研发提供了理论支持。

氯胺酮特异性抑制外侧缰核神经元
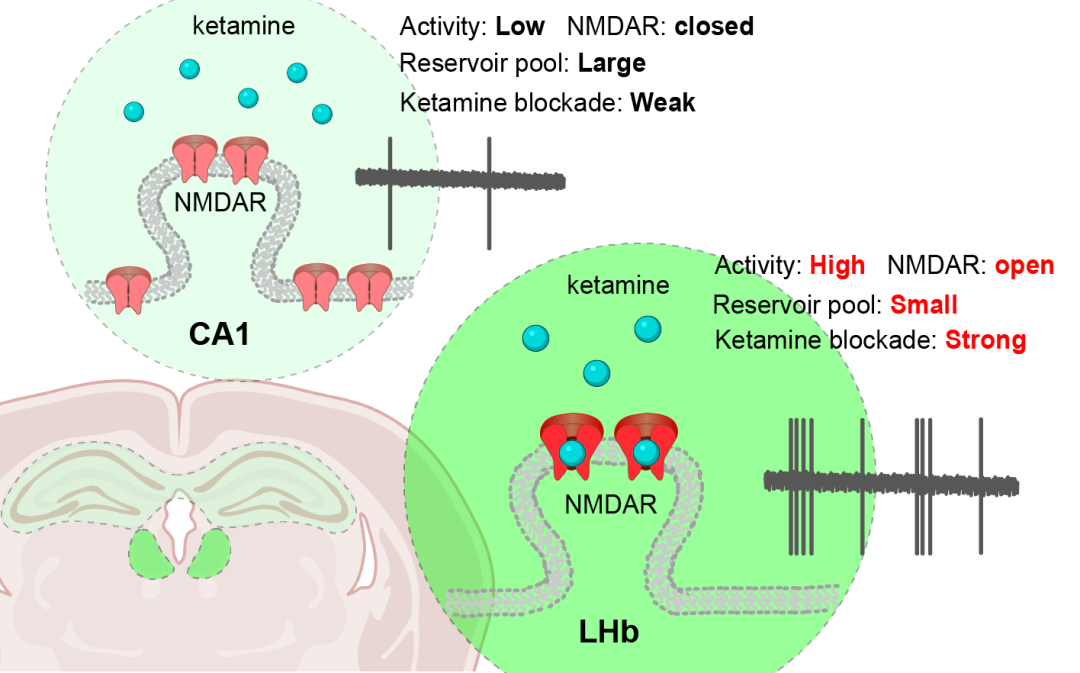
氯胺酮的主要分子靶点是NMDA谷氨酸受体[5]。然而,NMDA受体在全脑是广泛表达分布的。因此,一个重要的科学问题由此产生:氯胺酮在发挥其抗抑郁作用时是同时作用于全脑的NMDA受体还是特异性作用于一个或者少量的关键脑区,进而启动下游的一系列反应最终实现其抗抑郁的作用效果。为了回答这个问题,研究人员在慢性束缚应激抑郁造模的小鼠上腹腔注射抗抑郁剂量(10 mg/kg)的氯胺酮,然后在给药后1小时分别制备外侧缰核和海马CA1的脑片,电生理记录NMDA受体介导的突触电流,实验发现氯胺酮特异性抑制了外侧缰核神经元的NMDA受体电流而对海马椎体神经元的NMDA受体电流没有明显的抑制作用。除此之外,研究人员还在活体动物水平上进一步验证了氯胺酮注射只抑制了外侧缰核神经元的放电而没有影响海马椎体神经元的活动性。因此,离体和在体电生理的实验结果共同提示了氯胺酮对NMDA受体的抑制作用具有脑区特异性。
氯胺酮脑区特异性作用神经机制
针对氯胺酮脑区特异性作用的可能神经机制,结合氯胺酮作为活动性依赖的药物特点,研究人员首先猜测可能是由于不同脑区神经元的活动性高低差异造成的。在体电生理记录的实验结果确实显示在抑郁状态下外侧缰核神经元的活动性明显高于海马椎体神经元。为了进一步验证这一猜想,研究人员利用光遗传抑制外侧缰核神经元的活动性或者是用化学遗传增强海马神经元的活动性,成功逆转了这两个脑区神经元对于氯胺酮的敏感性,由此证明了神经元活动性确实影响了氯胺酮的作用效果。除此之外,研究人员在研究过程中还发现了外侧缰核神经元和海马神经元的一处不同:外侧缰核神经元的突触外NMDA受体储备明显小于海马神经元。该特征使得外侧缰核神经元突触NMDA受体被氯胺酮抑制之后其电流更难以恢复。综上所述,氯胺酮活动依赖的药物特性、不同脑区神经元的活动性高低以及不同脑区突触外NMDA受体的储备等原因共同导致了氯胺酮作用的脑区特异性作用。
图 氯胺酮的脑区特异性作用
研究过程中,团队还发现氯胺酮在naïve非抑郁动物上不具有和在抑郁动物上类似的抑制效果,说明氯胺酮的作用除了具有脑区特异性还具有状态依赖的特点,而这一特点很可能和外侧缰核神经元在抑郁状态下具有更高的神经元活动性[3, 6]相关,这同样符合我们的理论猜想。
外侧缰核是氯胺酮作用的起始靶点脑区
上述研究结果都提示了外侧缰核的NMDA受体是氯胺酮作用的潜在关键靶点。为了更加有力地证明这一点,研究团队通过转基因品系小鼠结合病毒的方式特异性局部敲除外侧缰核神经元的NR1(NMDA受体的亚基),发现局部基因敲除小鼠表现出抗抑郁的行为学表型。且在敲除小鼠上,氯胺酮不再具有快速抗抑郁的作用效果。该结果说明了外侧缰核的NMDA受体确实是氯胺酮抗抑郁作用的关键靶点。
过去的一些研究提示了除了外侧缰核这个脑区,还有一些其他的脑区参与了氯胺酮的抗抑郁作用[7-10],团队在研究过程也发现虽然氯胺酮腹腔注射没有明显抑制海马神经元的NMDA受体,但是在海马引起了5-HT和BDNF的升高。为了阐明氯胺酮对外侧缰核的抑制作用和其他脑区之间的联系,研究人员在外侧缰核局部敲除NR1的小鼠上腹腔注射氯胺酮,发现氯胺酮原本在海马引起的5-HT和BDNF升高明显减弱的。这一结果提示了外侧缰核是氯胺酮作用的起始脑区,其在海马引起的反应很可能是作为下游反应参与了氯胺酮的抗抑郁作用。
这项研究首先发现了氯胺酮的脑区特异性作用和状态依赖的特点,继而给出了一个统一的机制解释。从药物特性的角度出发,为氯胺酮的抗抑郁机制研究提供了独特的视角,为氯胺酮的临床用药和新型抗抑郁药物的研发改造提供了理论指导。这项研究还探究了外侧缰核脑区和其他脑区在氯胺酮抗抑郁作用中的先后联系,尝试将团队提出的理论体系和领域内其他研究作一个连结,希望最终能够帮助破解氯胺酮抗抑郁之谜。
胡海岚教授是本文的通讯作者,博士后陈敏为第一作者。此外,博士生马爽爽、特聘研究员刘含笑、博士生董一言、汤景翔、倪哲一、段陈迟、博士后檀毅、李辉、杨艳副教授、华盛顿大学Christopher Lingle教授等也在其中做出了重要贡献。本研究还得到了浙江大学段树民教授、黄荷凤教授,华东师范大学曹晓华教授、北京大学李毓龙教授的大力支持。李启靖教授、Carlos Zarate教授、李浩洪教授为本研究提供了宝贵的指导和建议。该研究主要受科技创新2030重大项目、国家自然科学基金、上海高等研究院繁星科学基金、新基石科学基金等项目的资助。
原文链接:https://science.org/doi/10.1126/science.ado7010
参考文献:
1. Berman, R.M., et al., Antidepressant effects of ketamine in depressed patients. Biol Psychiatry, 2000. 47(4): p. 351-4.
2. Zarate, C.A., Jr., et al., A randomized trial of an N-methyl-D-aspartate antagonist in treatment-resistant major depression. Arch Gen Psychiatry, 2006. 63(8): p. 856-64.
3. Yang, Y., et al., Ketamine blocks bursting in the lateral habenula to rapidly relieve depression. Nature, 2018. 554(7692): p. 317-322.
4. Ma, S., et al., Sustained antidepressant effect of ketamine through NMDAR trapping in the LHb. Nature, 2023. 622(7984): p. 802-809.
5. Anis, N.A., et al., The dissociative anaesthetics, ketamine and phencyclidine, selectively reduce excitation of central mammalian neurones by N-methyl-aspartate. Br J Pharmacol, 1983. 79(2): p. 565-75.
6. Li, K., et al., betaCaMKII in lateral habenula mediates core symptoms of depression. Science, 2013. 341(6149): p. 1016-20.
7. Li, N., et al., mTOR-dependent synapse formation underlies the rapid antidepressant effects of NMDA antagonists. Science, 2010. 329(5994): p. 959-64.
8. Zanos, P., et al., NMDAR inhibition-independent antidepressant actions of ketamine metabolites. Nature, 2016. 533(7604): p. 481-6.
9. Moda-Sava, R.N., et al., Sustained rescue of prefrontal circuit dysfunction by antidepressant-induced spine formation. Science, 2019. 364(6436).
10. Autry, A.E., et al., NMDA receptor blockade at rest triggers rapid behavioural antidepressant responses. Nature, 2011. 475(7354): p. 91-5.
来源:胡海岚课题组、浙江大学双脑中心公众号

 Search
Search