肿瘤细胞由于快速增殖,时常处于能量应激状态(如葡萄糖供给不足),需要动员储存在脂滴中的脂质,通过线粒体脂肪酸氧化磷酸化(β-氧化)来产生能量,以满足其快速增殖的需求。脂滴(lipid droplet,LD)是一种由单层磷脂膜包裹的细胞器,主要由甘油三酯和胆固醇酯组成的中性脂质核心构成。与正常细胞相比,肿瘤细胞持续地合成和摄取大量脂质,以促进肿瘤的快速增殖,并将多余的脂质储存于脂滴以备“饥饿”状态下提供能量。
细胞主要通过两种机制来利用储存在脂滴中的脂肪酸。第一种机制是通过脂滴-自噬体-溶酶体-线粒体途径,自噬体摄取脂滴,转运至溶酶体,水解释放脂肪酸,进一步运输到线粒体。第二种机制是通过脂滴-线粒体直接接触,脂滴招募脂肪酶,将脂滴中的甘油三酯水解为脂肪酸和甘油。然而,肿瘤细胞如何调节脂滴与线粒体的相互作用目前尚不明确。
2024年5月21日,浙江大学转化医学研究院/浙江大学医学院附属第一医院/国家基础科学中心/浙江大学基础交叉研究院筹备建设领域“生物+X”交叉研究领域吕志民教授团队在Nature Metabolism上在线发表了Glycolytic enzyme PFKL governs lipolysis by promoting lipid droplet–mitochondria tethering to enhance β-oxidation and tumor cell proliferation的文章,揭示了糖酵解酶PFKL通过其非经典功能-蛋白激酶功能,促进脂滴脂解的新机制。
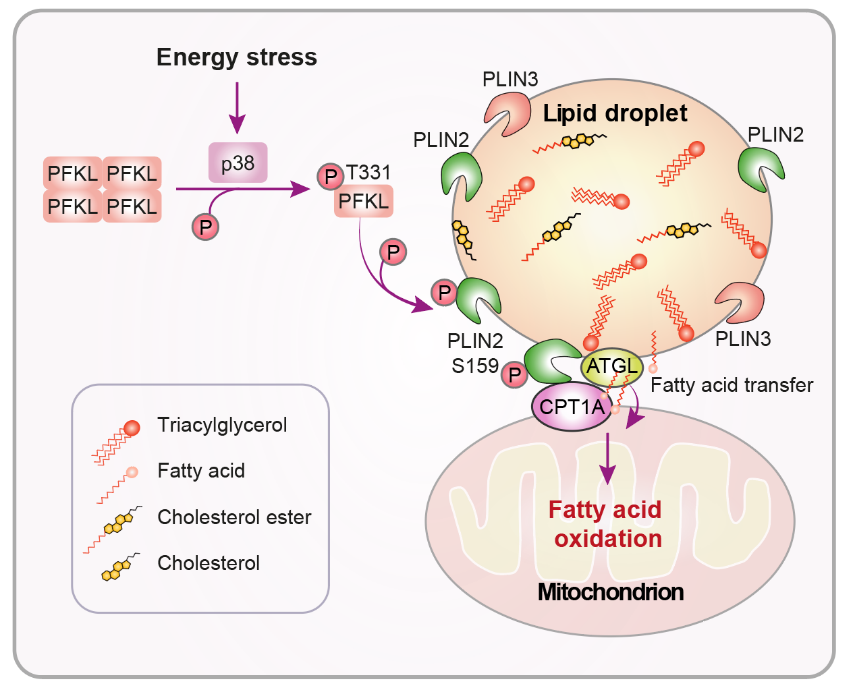
磷酸果糖激酶-肝型(PFKL)是糖酵解途径中的关键限速酶,通常位于细胞浆中,其功能是将果糖-6-磷酸(F-6-P)转化为果糖-1,6-二磷酸(F-1,6-BP)。该项研究发现,当肿瘤细胞处于葡萄糖缺乏的状态时,p38 MAPK被激活并磷酸化PFKL的Thr331位点,导致PFKL从四聚体转变为低代谢酶活性的单体形式,并转移到脂滴上,与脂滴膜蛋白PLIN2结合。重要的是,PFKL不依赖于其经典的代谢功能,作为一个蛋白激酶磷酸化PLIN2的Ser159位点。该磷酸化增强了PLIN2与线粒体膜蛋白肉碱棕榈酰转移酶1A(CPT1A)的结合,促进了脂滴与线粒体的相互作用,并招募脂肪酶ATGL至脂滴-线粒体接触区域,从而启动脂肪分解以及线粒体脂肪酸氧化磷酸化。动物实验表明,干扰这一过程可以抑制肿瘤细胞的增殖,促进细胞凋亡,并在小鼠肝癌模型中减缓肿瘤的生长。这些结果揭示了肿瘤细胞动态整合糖酵解、脂质代谢和线粒体氧化的关键机制。
综上所述,该研究阐明了PFKL在肿瘤细胞中的“双重身份”,其不仅是糖酵解途径中的关键限速酶,还能在能量应激时作为蛋白激酶调节脂滴与线粒体之间的相互作用,促进脂肪酸氧化以支持肿瘤细胞的生存和增殖。这一发现不仅加深了对肿瘤细胞代谢机制的理解,还为开发新的抗癌治疗策略提供了潜在的代谢标记物和分子靶点,对靶向肿瘤脂质代谢的抗癌药物开发具有重要的指导意义。
肿瘤中的大量基因突变以及特有的微环境往往会导致代谢酶原有的功能改变,并赋予其新的非代谢酶功能。该研究是吕志民团队继发现代谢酶PKM2(Nature, 2011, PMID: 22056988; Cell,2012, PMID: 22901803; Molecular Cell, 2014, PMID: 24316223)、PGK1(Molecular Cell,2016, 2017, 2019, PMID: 26942675, 28238651, 31492635)、KHK-A(Nature Cell Biology, 2016, PMID:2708854; Science Advances, 2019, PMID: 31032410)、PCK1(Nature, 2020, PMID: 32322062)、CHKα(Molecular Cell,2021,PMID: 34077757)和HK2(Cell Metabolism, 2022, PMID: 36007522)的蛋白激酶活性在肿瘤发生发展中发挥重要作用之后,发现的又一个具有蛋白激酶活性的代谢酶。这些成果对于全面系统认知肿瘤代谢具有开创性的理论意义。
原文链接:https://www.nature.com/articles/s42255-024-01047-2
来源:浙大转化院公众号

 Search
Search

