6月10日,浙江大学基础交叉研究院交叉原创板块成员、药学院顾臻教授团队,基础交叉研究院交叉原创板块成员、化学系唐睿康教授及刘昭明研究员团队联合在Nature Cancer期刊发表题为“Long-acting IL-2 release from pressure-fused biomineral tablets promotes antitumor immune response”的研究论文。该研究通过压力融合多组分无机矿物,从而融合不同矿物的结晶动力学特性,实现药物的长效可控释放,在小鼠肿瘤模型中诱导出长效免疫,展现出良好的长期抗肿瘤效果。药学院韩金鹏博士,王慎强教授和化学系方威风博士研究生为该工作第一作者。
长效缓释制剂的临床挑战与需求
长效缓释制剂通过延长药物作用时间和减少给药频率,可有效改善药代动力学不佳药物的疗效。然而,传统缓释技术(如聚合物微球、凝胶等)时常存在突释效应明显等问题,较难实现药物在长效周期内的可控释放,以解决药物剂量依赖毒性和耐受性等问题。
仿生灵感与技术突破
研究团队受生物体利用无定形前驱体颗粒融合产生具有连续结构矿物骨架行为的启发,发明了一种压力诱导、可便捷制备的药物植入片剂(图1),通过调控结构水含量和施加外部高压(2 GPa,约为1个标准大气压的2万倍),实现无机矿物颗粒辅料无缝融合,形成均匀的无定形矿物片剂,解决传统辅料简单混合导致药物长效不可控释放的难题,在动物荷瘤模型中展现出良好的抗肿瘤效果。
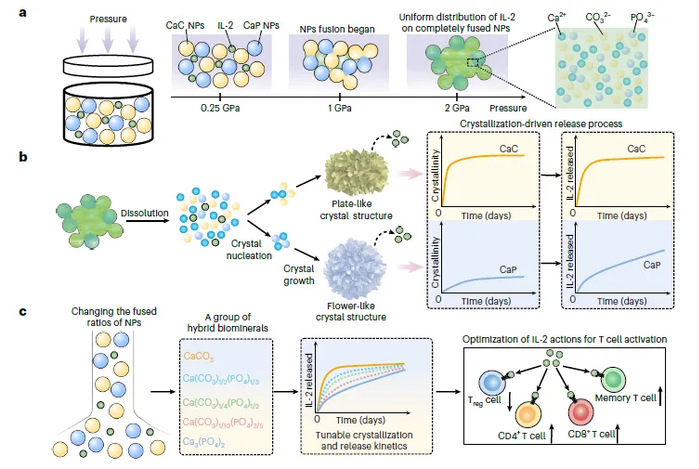
图1. 高压融合药物植入片剂制备示意图。a,压力驱动碳酸钙(CaC)和磷酸钙(CaP)纳米颗粒结构融合。b,矿物植入片剂的溶解-再结晶路径驱动药物长效释放。c,植入片剂展现出同步可调结晶动力学驱动的长效可控药物释放,优先激活效应和记忆T细胞,同时抑制调节性T细胞活性。
高压融合技术突破白细胞介素-2递送瓶颈
白细胞介素-2(IL-2)是一种关键免疫调节因子,可激活效应T细胞和自然杀伤细胞,增强其杀伤肿瘤的能力。然而,IL-2的临床应用面临的瓶颈包括:1)半衰期极短:体内半衰期仅85分钟,需频繁注射;2)剂量依赖性毒性:高剂量引发血管渗漏综合征和心脏毒性;3)免疫抑制风险:低剂量优先激活调节性T细胞(Tregs),抑制免疫反应。这些限制使得IL-2的“治疗窗口”极窄,临床疗效受限。因此,开发一种能够精准长效控制IL-2释放、延长局部作用时间并减少全身毒性的给药系统,成为突破现有困境的关键。

图2.免疫治疗植入片剂表征。a,b,不同压力诱导矿物植入片剂融合的照片(a)和扫描电镜图片(b)。比例尺:4毫米(a);1微米(b)。
为实现无定型碳酸钙和磷酸钙矿物颗粒结构融合,通过增加外部压力至2 GPa,可诱导矿物边界消失,形成均匀连续的矿物界面,由此制备的药物植入片剂呈现透明特征(图2)。与瘤内直接注射IL-2相比,瘤内植入片剂展现出显著的疗效优势和生物安全性,肿瘤内IL-2含量显著增加且未发生血管渗漏等不良现象。
长效控释,精准抑瘤
在小鼠皮下黑色素肿瘤复发模型中,单次植入优化后片剂,使得60%的小鼠未发生肿瘤复发,疗效显著优于对照组。在小鼠黑色素肿瘤远端未治疗模型中,单次植入优化后片剂,肿瘤微环境内树突细胞和T细胞含量显著增加,激活抗肿瘤免疫效应。在植入片剂治疗3个月后,小鼠依旧展现出优异的免疫防护作用,并有效抑制再次接种的黑色素肺转移肿瘤的生长。在小鼠原位胰腺肿瘤模型中,植入片剂联合临床一线药物程序性细胞死亡蛋白-1制剂(PD-1)能有效抑制原位肿瘤的生长,显著延长小鼠生存期。
本研究将高压融合技术应用于药物植入片剂的制备,以期解决药物治疗中“活性-毒性”难以平衡的难题。在时间维度上,通过结晶动力学精准调控,实现IL-2作为模式药物的精准释放;在空间维度上,通过局部高浓度药物蓄积,显著降低全身暴露风险。作为制剂技术平台,这种新型高压制片技术有望用于其他药物应用场景的拓展。
原文链接:
https://www.nature.com/articles/s43018-025-00993-4
内容来源丨相关研究团队、齐物论公众号

 Search
Search

