近日,浙江大学基础交叉研究院交叉原创板块成员、化学系冯建东教授、化学系谈洁研究员在Advanced Science发表题为“Spatially Resolved Mapping of Voltage-Gated Proton Channel Activity Reveals Delayed Proton Transport in Local Microenvironments” 的研究成果。
电压门控质子通道蛋白1(Hv1)是细胞膜上调控质子(H+)跨膜转运的关键蛋白,在调控细胞内pH稳态、神经递质释放及免疫应答等生理过程中扮演核心角色。尤其在神经退行性疾病(如阿尔茨海默病)中,Hv1的过度表达与氧化应激和神经炎症密切相关,但其精确的致病机制仍不清晰。其中一个重要技术瓶颈在于,传统研究方法难以在活细胞中原位、实时地捕捉单个Hv1通道的质子转运行为及其如何塑造纳米尺度的局域pH微环境。经典的膜片钳技术虽能监测单个通道的电信号,但其测量通量较低且测量时需对通道进行隔离,无法在细胞天然状态下实现原位成像;而荧光成像技术则受限于光漂白和定量困难,无法将光子数信号与单个通道的动力学直接关联。
本研究开发了融合表达荧光蛋白的Hv1通道,利用荧光蛋白的光漂白特性,发展了创新的单分子光漂白定量成像平台,实现了对Hv1通道质子转运的直接可视化与精确定量。该技术具备高通量和超分辨率定位能力,可以在大视场(~3000μm2)内实现高通量(~2300个可分辨的独立质子通道)单个质子通道的映射,克服了传统电生理学检测的时空限制。该技术首次在生理模型系统中清晰捕捉到由单个通道活动产生的质子流入与流出现象,并直接证实Hv1通道能够在其周围形成高度局域化的pH微环境。同时,我们观察到在拟病理高渗条件下,Hv1通道动力学延迟了约7倍,减缓了胞内Hv1介导的pH稳态维持动力学,为神经病理学研究提供了全新的视角。通过将融合的pH luorin荧光蛋白替换为相应的离子敏感荧光蛋白,这项技术可轻松拓展至其他电压门控通道(如钙离子通道、钾离子通道与钠离子通道),将有力推动神经科学、肿瘤免疫学、细胞间相互作用与通讯、以及合成生物学等领域的发展。通过提供通道蛋白的调控特性与电压依赖性门控信息,该研究将为靶向通道蛋白的高通量药物筛选研发提供重要支撑。
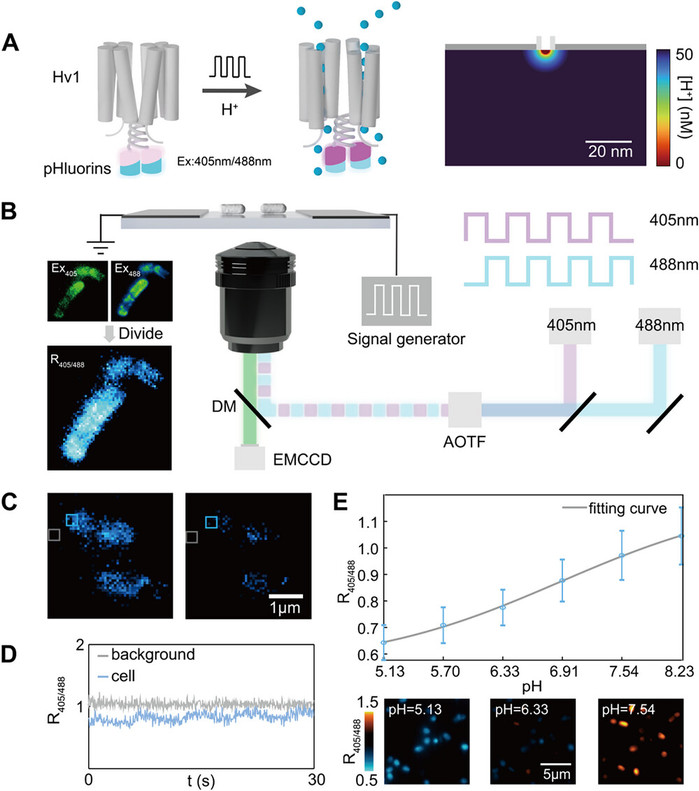
电压门控与pH梯度对Hv1通道动力学的协同调控
原文链接:https://doi.org/10.1002/advs.202510837

 Search
Search

